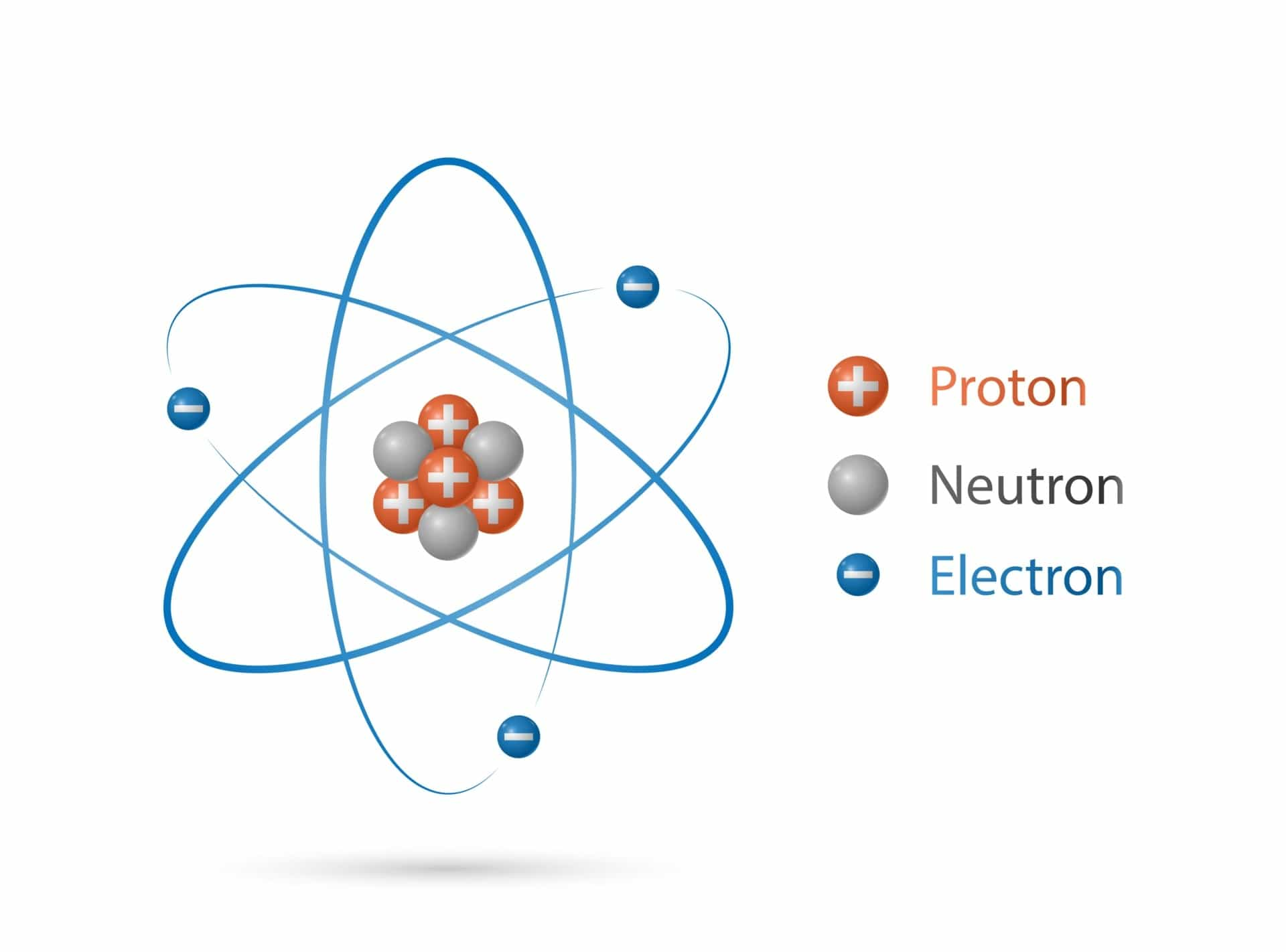
Etrafınızda gördüğünüz her şey maddeden oluşur ve tüm maddeler atomlardan meydana gelir. Atomlar daha da parçalanabilir mi? Kesinlikle. Atomlar protonlardan, nötronlardan, elektronlardan ve çoğumuzun farkında olmadığı bir dizi farklı atom altı parçacıktan oluşur.
Şimdi, eğer her şey atomlardan oluşuyorsa ve atomların kendisi de atom altı parçacıklardan meydana geliyorsa, atom altı parçacıkların birleşimindeki bir değişiklik yeni, farklı bir madde türüyle sonuçlanır mı? Kesinlikle olur.
Eğer bir atomdan bir elektron çıkarırsanız, geriye pozitif yüklü bir iyon kalır ve bu iyon zıt yüklü başka bir iyonla bağ kurmaya hazırdır. Bir atomdan bir proton çıkarılır ya da atoma bir proton eklenirse, yepyeni bir element oluşur (çekirdeği sabit tutmak için aynı sayıda nötron eklemeniz ya da çıkarmanız da gerekir). Ancak, bir atom çekirdeğinden nötr yüklü bir nötron çıkardığınızda ne olur? Belki de yeni bir element?
İzotoplar
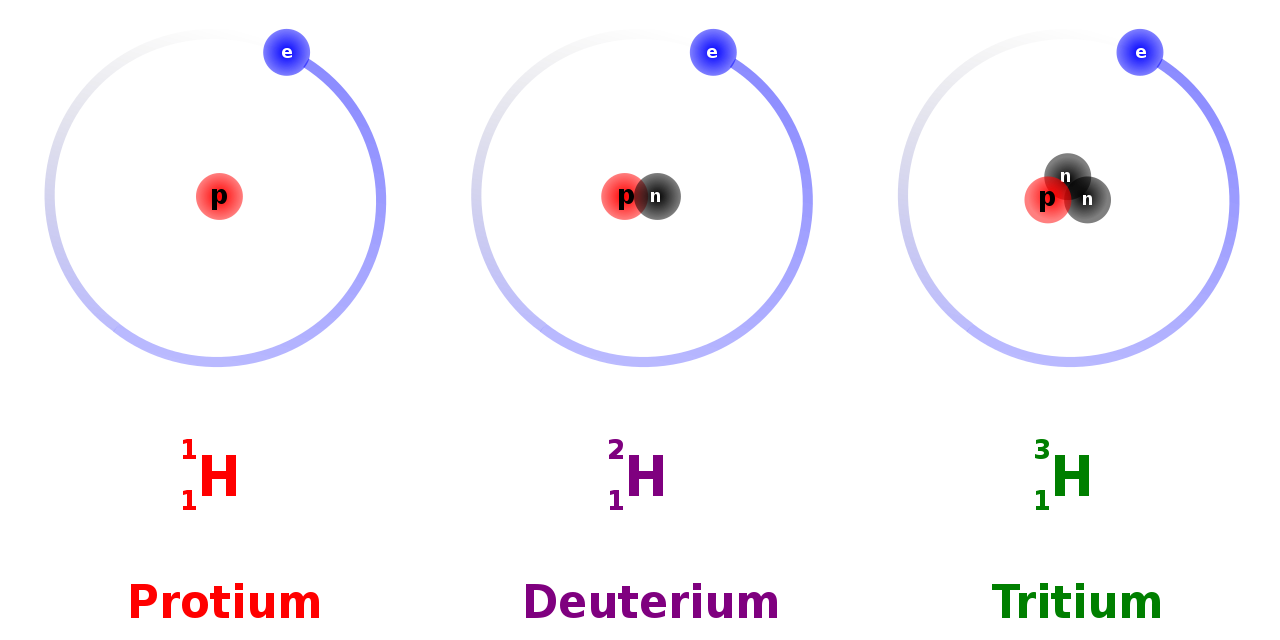
Bir atomun çekirdeğine bir nötron eklediğinizde veya çıkardığınızda, teknik olarak yeni bir element elde etmezsiniz, ancak elinizde aynı elementin yeni bir türü olur. Bu yeni türe elementin "izotopu" denir. İzotoplar resmi olarak aynı sayıda protona sahip ancak çekirdeklerinde farklı sayıda nötron bulunan elementler olarak tanımlanır. İzotopların bir başka tanımı da onları aynı atom numarasına (proton sayısı), ancak farklı atomik kütle numaralarına (bir atomun nötron ve protonlarının toplamı) sahip atomlar olarak tanımlar. Bir elementin izotopları da aynı sayıda elektrona sahiptir.
Tamam, izotop kavramını daha erişilebilir bir şekilde anlamak için yeni piyasaya sürülen iPhone'ları kullanalım. Apple kısa süre önce Apple iPhone serisinde iPhone 14, iPhone 14 Pro ve iPhone 14 Pro Max olmak üzere üç yeni cihaz piyasaya sürdü. Pro ve Pro Max, iPhone 14'ün farklı bir varyantı veya türünden başka bir şey değildir. İkisi de aynı A16 Bionic çipi kullandıkları için ya da sadece 2022 yılında piyasaya sürüldükleri için iPhone 14'ün bir türü olarak tanımlanabilir.
Tüm elementler yalnızca atom numaralarına, yani çekirdeklerindeki proton sayısına göre tanımlanır. Dolayısıyla, iPhone'lara benzer şekilde, aynı sayıda protona (A16 çipli iPhone'lar), ancak farklı sayıda nötrona (farklı kamera sayısı veya pil boyutu) sahip elementler, tamamen yeni bir element yerine aynı elementin farklı türleri olarak tanımlanır.
İzotopların Tarihçesi
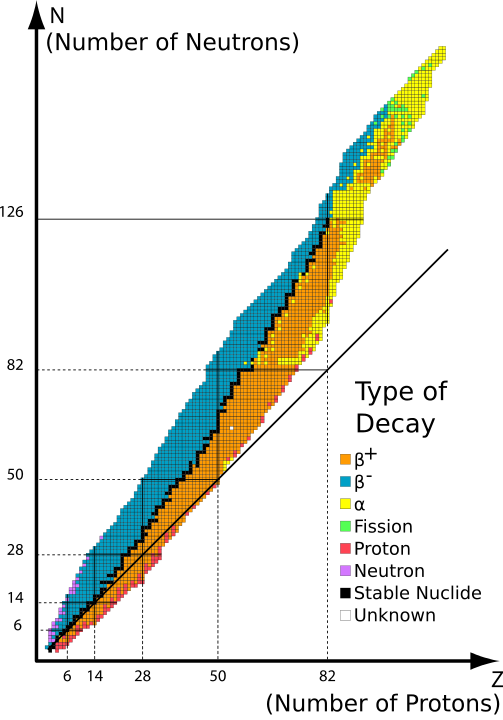
Radyoaktif izotopların varlığı ilk kez 1913 yılında bir radyokimyacı olan Frederick Soddy tarafından radyoaktif basamakları (bir dizi radyoaktif bozunma) incelerken fark edilmiştir. Soddy, uranyum ve kurşun arasında 40 farklı element türü (radyoelement olarak adlandırılır) buldu. Ancak periyodik tablo bu ikisi arasında sadece 11 elemente izin veriyordu. Bu 40 elementi periyodik tabloya yerleştirmek amacıyla Frederick Soddy ve Kazimierz Fajans radyoaktif yer değiştirme teorisini ortaya attı.
Teori, alfa bozunmasının (bir atomun helyum çekirdeği, yani 2 proton ve 2 nötron yaydığı radyoaktif bozunma) periyodik tabloda ana elementin iki sıra solunda bir element ürettiğini, beta bozunmasının (bir elektron veya pozitron yayılması) ise ana elementin bir sıra sağında bir elementle sonuçlandığını öne sürdü.
Ancak Soddy, bazı radyoelementlerin farklı atom ağırlıklarına/kütlelerine sahip olduklarını, ancak ana elementlerinin kimyasal özelliklerini koruduklarını ve bu nedenle periyodik tabloda aynı yeri işgal etmeleri gerektiğini fark etti. Frederick Soddy'nin bir arkadaşı olan Margaret Todd, bu radyoelementler için "izotop" terimini icat etti. İzotop kelimesi Yunanca "aynı yerde" anlamına gelmektedir. Soddy, radyoaktif elementlerin anlaşılmasına ve izotopların araştırılıp keşfedilmesine yaptığı katkılardan dolayı 1921 yılında Nobel kimya ödülüne layık görülmüştür. J. J. Thomson bir elementin ilk kararlı izotoplarını 1913 yılında bulmuştur.
İzotoplar Arasındaki Nitelik Farkı
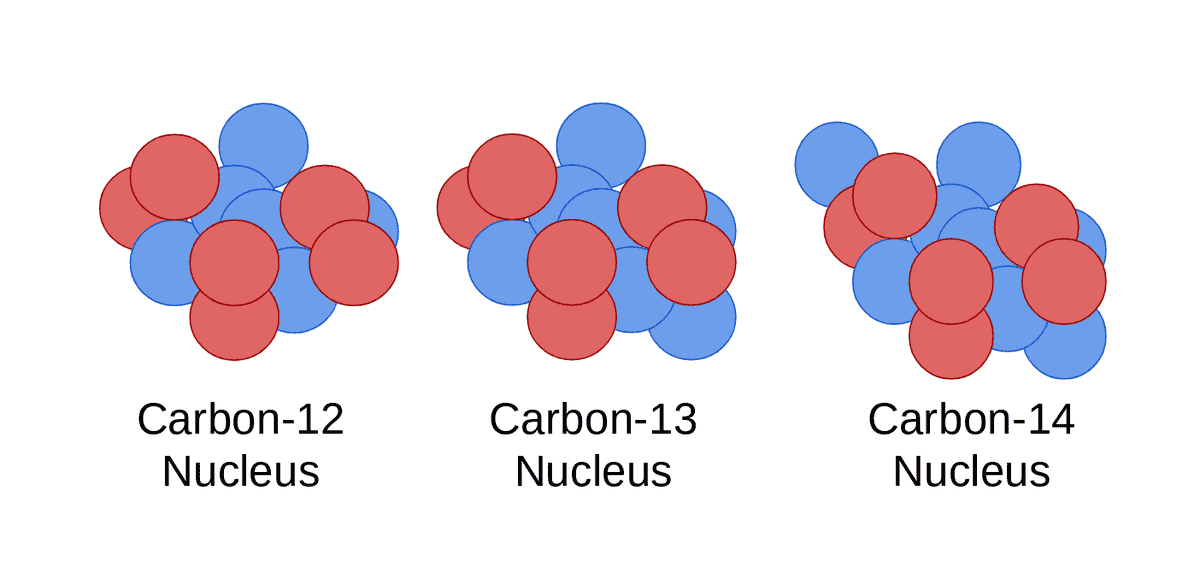
Basit olması açısından, bir elementin özelliklerini iki kısma ayırabiliriz – kimyasal özellikler ve fiziksel özellikler. Kimyasal özellikler, bir elementin ve dolayısıyla atomlarının bileşikler veya diğer elementleri oluşturmak için kimyasal reaksiyonlara girme yeteneği ve eğilimidir. Bu özellikler atomda bulunan elektron sayısına göre belirlenir. Bir elementin izotopları farklı sayıda nötrona, ancak aynı sayıda elektrona sahip olduklarından, benzer kimyasal özelliklere sahiptirler. Bununla birlikte, hidrojen izotopları bir istisnadır.
Öte yandan, bir elementin kaynama noktası ve erime noktası gibi fiziksel özellikleri atomik kütle numarasına bağlıdır. Kütle numarasındaki bir farklılık, bir izotopa ebeveyninden farklı fiziksel özellikler kazandırır. Bununla birlikte, izotopların nükleer özellikleri birbirinden farklıdır ve sınıflandırılmalarının da temelini oluşturur.
İzotoplar kararlılıklarına veya bozunma eğilimlerine göre sınıflandırılır. Doğal olarak oluşan 339 izotoptan yaklaşık 252'sinin kararlı olduğu kabul edilir. Ancak bunlardan sadece 146'sı gerçekte kararlıdır, diğer 106'sı ise teorik olarak bozunmaya yatkındır. Şu ana kadar böyle bir gözlem yapılmadığından, bunları gözlemsel olarak kararlı kabul ediyoruz.
Ayrıca, doğal olarak oluşan 339 izotoptan 286'sı ilkseldir, yani Güneş Sistemi'nin oluşumundan bu yana var olmuşlardır. Yapay olarak yaratılanlarla birlikte şu ana kadar doğrulanmış izotopların toplamı 3.300'ün üzerindedir. Bunların 2,400'den fazlasının yarı ömrü 60 dakikadan azdır. Her elementin bir ya da daha fazla radyoaktif izotopu bulunurken, atom numarası 83'ten büyük olan elementlerin sadece radyoaktif izotopları vardır.
Sonuç
Bu büyüleyici bir konu olabilir, ancak nötronları bir atomun çekirdeğinden çıkarmak hiç de kolay bir iş değildir. İzotoplar öncelikle nükleer reaktörlerin kullanılmış çubuklarında, nükleer reaksiyonların yan ürünleri olarak bulunur. Yapay olarak, kararlı atomların bir parçacık hızlandırıcıda alfa parçacıklarıyla (helyum çekirdeği) bombardıman edilmesiyle üretilirler. Diğer yöntemler arasında ana izotopların bir nükleer reaktörde nötronlarla ışınlanması veya bir siklotron kullanılması yer alır.
Radyoaktif izotoplar çeşitli alanlarda kullanım alanı bulmaktadır. En umut verici olanı nükleer tıp disiplini ve kanser tedavisidir. Endüstriyel kullanım alanları arasında iç güvenlik, gıda ışınlama, endüstriyel radyografi, jeoloji, astronomi vb. yer almaktadır. Gelecekte daha fazla izotop keşfetmeye devam ettikçe, daha fazla yeni kullanım alanları bulunacaktır.