Periyodik tablonun tarihi, tüm maddenin temel bileşenleri ve varlığımızın yapı taşları olan elementlerin düzenine yönelik bir araştırmayı işaret eder. Sibirya'nın en uzak köşelerinden gelen Dimitri Mendeleyev, basit bir tabloyla dünyayı değiştirdi. Dimitri Mendeleyev'in 1869'da önerdiği şey, evrenin temeli olan elementlerin düzenini içeriyordu.
Elementlerin altında yatan temel bir sıra ya da düzen olup olmadığı sorusu ilk olarak eski bilginler tarafından ortaya atılmıştır. Bazı maddelerin birbirlerine diğerlerinden daha çok benzediğini fark ettikten sonra elementler arasındaki düzeni ayırt etmeye çalıştılar.
Ancak Dimitri Mendeleyev ve birkaç yıl sonra başkalarının da geliştirdiği periyodik elementler tablosu kritik bir ilerlemeyi temsil ediyordu. Mendeleev, bilinen elementleri atom ağırlıklarına ve biçimsel özelliklerine göre düzenlemenin yanı sıra, altta yatan düzenlilikleri de tanımladı.
Son birkaç on yılda fizik ve biyolojide tüm dünya görüşleri çökerken, Rus kimyacının Periyodik Tablosu zamana meydan okudu. İster nükleer fisyon, ister yeni element gruplarının keşfi, isterse de atomik yapının anlaşılması olsun, kimya ve atom fiziğindeki tüm ilerlemeler Mendeleev'in parlak tasarımını doğrulamaya ve genişletmeye hizmet etmiştir. Peki ama onun keşfinin sırrı tam olarak neydi?
Element Nedir?

İlksel Maddeyi Bulmak
Her şeyin kökeni nedir? Metal neden sert ve su neden sıvıdır? Kömür ve sülfür neden bakır ve gümüşten farklı davranır? Bunlar kesinlikle modern çağın meseleleri değildir; eski insanlar zaten bunlarla uğraşıyordu. Onlar da doğal dünyayı hafife almaktan vazgeçmiş ve onun temellerini anlamaya can atmışlardır.
İlk Yunan doğa bilimcileri ve filozofları evrende bir tür düzen ya da birleştirici ilke olması gerektiği konusunda hemfikirdi. Belki de farklı maddelerin nasıl davrandığını ve nasıl belirli özelliklere sahip olduğunu açıklayan ilksel bir malzeme vardır. MÖ 600 yılında Miletli Yunan filozof Thales için çözüm çok açıktı: Su. Dünya diskindeki her şeyin bu ilksel maddenin farklı bir yönü olduğunu düşünmektedir. Bugün biliyoruz ki yeterince ısıtıldığında katı, sert metaller bile sıvı hale dönüşebilir. En fazla, Herakleitos'un öne sürdüğü gibi ateşin mi yoksa havanın mı esrarengiz ilksel madde olduğu tartışılıyordu.
Aristoteles'in Dört Elementi
Aristoteles bu teorileri yaklaşık 300 yıl sonra dört element doktrininde birleştirmiştir. Burada her bir "elemente" karakteristik özellikler verdi; örneğin, toprak soğuk-kuru ve su soğuk-nemli. Tüm madde kendisini oluşturan parçaların bir bileşimi olduğundan, bir maddenin özellikleri ve davranışları bu parçaların oranına bağlıdır. Ancak Aristoteles'e göre her şeyin ötesinde, diğer her şeye hayat veren ve tüm varoluşun kaynağı olan öz, beşinci element, eter vardı.
Aristoteles'in o zamanlar bilmediği şey, fikirlerinin Batı dünya görüşünü neredeyse 2000 yıl boyunca etkileyeceğiydi. Yunanlılar ve Romalılardan Orta Çağ ve Rönesans'ın simyacılarına ve doktorlarına kadar herkes dört temel elemente atıfta bulunmuştur.
Robert Boyle: Modern Kimya Çağı

Robert Boyle adında, Cork Kontu'nun en küçük oğlu olan genç bir İrlandalı, bu dönemi aniden sona erdirdi ve 17. yüzyılda modern kimyanın başlangıcını ilan etti. Boyle 12 yaşındayken, o dönemde aristokratlar için alışılageldiği üzere bir süre Krallık'ta kaldı. Fransa, İsviçre ve İtalya'yı ziyaret ederek dönemin en büyük bilginlerinden eğitim aldı ve aynı zamanda birçok şarlatan ve simyacıyla arkadaşlık kurdu. 1644 yılında İrlanda'ya döndü ve kendi deneylerini yapmaya başladı; kaynatıyor, buharlaştırıyor ve damıtıyor, bir yandan da nesneleri mikroskop altında inceliyordu. Özellikle gazların davranışları ilgisini çekiyordu.
Gerçek bilimsel araştırmalardan ziyade varsayımlara dayandıkları için Boyle, Aristoteles ve Paracelsus'un dört element teorilerini giderek daha fazla sorgulamaya başladı. Boyle, maddelerin birleşmesinin ya da sadece karışmasının bir fark yarattığını ve birçok maddenin çok büyük ölçüde parçalanabildiğini, ancak bazılarının parçalanamadığını gözlemledi. Bu maddelerden biri de eczacı ve simyacı Hennig Brand'ın birkaç yıl önce keşfettiği fosfordu. Buharlaştırma ve yumuşatma tavlaması yoluyla idrardan elde edilen bu maddenin inanılmaz derecede kararlı olduğu ve daha fazla parçalanmaya direnç gösterdiği görülmüştür.
Boyle 1661'de kesin olarak dörtten fazla element olması gerektiğinden emindi. Ayrıca tüm maddeler daha fazla kimyasal reaksiyona giremiyorsa temel olmalıdır. İrlandalı bilim adamı ve doğa filozofu, "The Sceptical Chymist" (Şüpheci Kimyager) adlı kitabında yayınladığı yeni kavramıyla simya çağına son verdi; artık modern kimya vardı.
Karlsruhe Kongresi İlk Kıvılcımı Yaktı

İlk Uluslararası Kimya Kongresi
Karlsruhe, 3 Eylül 1860: İkinci toplantı odası hareketlilikle dolup taşıyor. 140 adam birbirleriyle tokalaşıyor, konuşuyor ve el kol hareketleri yapıyor, çoğu da parlak koyu renk takım elbiseler giymiş. Ve sonunda toplantı başlar. Açılışı Karlsruhe'deki Politeknik Okulu'nda kimyager ve toplantı organizatörü olan Karl Weltzien şu sözlerle yapmıştır:
Geçici başkan olarak, daha önce hiç var olmamış, eşi benzeri görülmemiş bir kongreyi açma onuruna sahibim. İlk kez tek ve gerçekten de en yeni doğa biliminin temsilcileri burada bir araya geldi.
Tarihe geçen ilk Uluslararası Kimya Kongresi resmi olarak bu sözlerle açıldı. Çünkü Karlsruhe Kongresi, Periyodik Tablo da dahil olmak üzere çağdaş kimyadaki en önemli gelişmelerden bazıları için bir katalizör görevi gördü. Robert Bunsen, Dimitri Mendeleyev, August Kekulé, Jean-Baptiste Dumas, Carl Fresenius ve Louis Pasteur gibi tanınmış araştırmacıların yanı sıra kongre, bu yeni alandaki en parlak beyinleri bir araya getirdi.
Atomik Ağırlık Karmaşası
Ancak yine de büyük bir çekişme, tartışma ve kavga devam ediyordu. Çünkü kongrenin konusu her şeyin temelinden başka bir şey değildi: Atomlar. Ya da daha doğrusu atom ağırlıkları.
Atomların maddenin temel birimleri olduğu zaten evrensel olarak kabul edilmişti. Ancak bir atomun ağırlığını belirtmenin altı farklı yolu vardı. Bazıları hidrojeni her şey için standart olarak kabul edip ona 1 atom ağırlığı verirken, diğerleri oksijeni en üstün güç olarak görüyor ve diğer tüm atom ağırlıklarını ona dayandırıyordu. Ancak bu sadece belirsizliğe yol açmakla kalmadı, aynı zamanda analiz edilen bir maddenin element olup olmadığını belirlemeyi de zorlaştırdı.
Dimitri Mendeleyev adında genç bir Rus kimyager de kongre katılımcılarından biriydi. Mendeleyev, Rusya'nın en ücra eyaleti olan Uralların doğusundaki Tobolsk kasabasından olmasına rağmen St. Petersburg'daki prestijli üniversiteye devam edebilmişti. Hatta yüksek lisans derecesini aldıktan sonra Fransa ve Almanya'ya iki yıllık bir eğitim gezisine gönderilmişti. Mendeleyev, Robert Bunsen ve daha sonra Gustav Kirchhoff'un Heidelberg laboratuvarlarında doktorasını sürdürürken öncelikle fiziksel kimyaya odaklandı. Araştırmaları arasında moleküler ağırlıkların ve sıvıların kesin hacimlerinin ölçülmesi de vardı.
Bir İtalyan Çözümü

İtalyan kimyager Stanislao Cannizzaro'nun konuşması kongrenin üçüncü ve son gününde yapıldı. Cannizzaro, atom ve molekül ağırlıkları sorununa Amadeo Avogadro'nun gaz yasasına dayanan bir çözüm önerdi. Bu teoriye göre, ideal bir gaz aynı hacim, basınç ve sıcaklıkta her zaman aynı sayıda parçacığa sahip olmalıdır. Avogadro bu bağlamda "parçacık" terimini iki atomlu molekülleri ifade etmek için kullanmıştır. Cannizzaro konuşmasında, "Bu nedenle buhar yoğunluğu bize, ister atomik ister bileşik olsun, farklı maddelerin moleküllerinin ağırlığını kesin olarak belirlemenin bir yolunu sağlar" diyordu.
Cannizzaro bu öneriyi yaptığında odada henüz 26 yaşında olan Mendeleyev de bulunuyordu. Mendeleyev için periyodik tablo niteliğindeki bu konuşma bir başlangıç noktasıydı. Ne de olsa, bilinen yaklaşık 60 elementin nasıl kategorize edileceği konusu birkaç yıldır kafasını meşgul ediyordu. Mendeleyev daha sonra bir yazısında şöyle demiştir: "Doğada genel bir düzen ilkesinin varlığını keşfetmek ve bu düzeni yöneten nedenleri bulmak bilimin işlevlerinden biridir. Bilimin mükemmel katedrali sadece malzemeye değil, bir tasarıma, bir uyuma da ihtiyaç duyar."
Mendeleyev bu görüşte yalnız değildi; birçok atom ağırlığının düzeltilmesine ve birleştirilmesine yol açan Karlsruhe'deki kongre, elementlerin özelliklerini ve davranışlarını ilk kimin açıklayabileceğini görmek için gerçek bir yarış başlattı.
Çeşitli Elementler Arasındaki Gizemli Benzerlik
1860 Karlsruhe Kongresi'nden önce bile birçok kimyacı, tüm elementler aynı olsa da bazılarının diğerlerinden daha benzer olduğunu fark etmişti. Bu, bazı elementlerin bir şekilde ilişkili olabileceğini düşündürüyordu. Örneğin, aşağıdaki elementlerin üçü de -klor, brom ve iyot- gaz halindedir veya çok az uçucudur, yoğun renklidir ve metaller ve hidrojenle oldukça reaktiftir. Buna karşın, lityum, sodyum ve potasyum gibi bazı maddeler katıdır ve su ile güçlü bir reaksiyona sahiptir.
Bununla birlikte, bu ilgili gruplar arasında bile net ayrımlar vardır: Lityum su yüzeyinde yavaşça hareket eder, su ile reaksiyona girer ve yok olana kadar hidrojen yayar. Bir parça sodyum ise yüzeyde şiddetle hareket eder ama ateş almaz. Potasyum ise suya temas ettiği anda alev alır, soluk mor bir alevle yanar ve her yere kendisinden kürecikler püskürtür.
Döbereiner'in Üçlüleri
Alman kimyager Johann Wolfgang Döbereiner de 1829 yılında bu benzerlikleri fark etmiştir. Birbiriyle ilişkili kalsiyum, stronsiyum ve baryum elementlerini yan yana koyduğunda, stronsiyumun atom ağırlığının diğer ikisinin ortalamasına tam olarak eşit olması, atom ağırlıklarının bu yakınlıklarda bir faktör olduğunu gösteriyordu.
Lityum, sodyum ve potasyum bu özelliği paylaşan bir başka üçlü oluşturdu. Sonuçta Döbereiner'in " Üçlüler Yasası (Triadlar Yasası)" o dönemde var olduğu bilinen 53 elementten 30'unun gruplandırılmasına olanak sağlıyordu. Oksijen, hidrojen ve nitrojen gazları gibi diğer elementler onun teorisine uymak istemedi. Onun çağdaşları da öyle yaptı. Tüm durumu "yeterince ikna edici" bulmadılar.
Triadlar Yasası
Triadlar Yasası, Alman kimyager Johann Wolfgang Döbereiner tarafından 19. yüzyılın başlarında önerilen, kimyasal elementleri sınıflandırmaya ve özelliklerindeki desenleri tanımlamaya yönelik erken bir girişimdi. Döbereiner'ın fikri, üçlü gruplara elementleri yerleştirme fikrine dayanıyordu ve bu üçlü grupların ortadaki elementin özelliklerinin diğer iki elementin ortalaması olduğu bir yaklaşımı içeriyordu.
Döbereiner tarafından önerilen en ünlü üçlülerden biri alkali metal üçlüsüydü:
- Lityum (Li) – Atom ağırlığı 7
- Sodyum (Na) – Atom ağırlığı 23
- Potasyum (K) – Atom ağırlığı 39
Bu üçlüde, sodyumun (Na) atom ağırlığı lityumun (Li) ve potasyumun (K) atom ağırlıklarının yaklaşık ortalaması olduğu görülmektedir.
Döbereiner ayrıca halojen üçlüsü (klor, brom ve iyot) ve kalsiyum stronsiyum baryum üçlüsü gibi diğer üçlüler de önerdi. Onun fikirleri elementlerin özelliklerindeki periyodisiteyi anlama ve periyodik tablonun erken gelişimine katkıda bulundu, ancak sonradan Dimitri Mendeleyev'in periyodik tablosu tarafından daha kapsamlı ve doğru bir şekilde değiştirildi. Mendeleyev'in periyodik tablosu, keşfedilmemiş elementlerin varlığını ve özelliklerini başarıyla tahmin etti ve ona kimya alanında daha büyük bir tanınırlık kazandırdı.
Oktavlar Yasası
35 yıl sonra, İngiliz kimyager John Reina Newlands, Karlsruhe'deki "düzenlenmiş" atom ağırlıklarıyla desteklenen bir element sıralaması girişiminde bulundu. Newlands, bilinen elementleri atomik kütlelerine göre artan sırayla listeleyerek işe başladı. Bu sıralamadaki elementlerin özelliklerinin bir model izlediğini hemen fark etti: Daha önceki yedi maddenin temel özellikleri her sekizinci elementten sonra tekrarlanıyordu. Bu durum John Newlands'a müziği ve aynı notanın farklı bir perde ile tekrarlanabileceğini ifade eden oktav prensibini düşündürdü. Sonuç olarak keşfine "Oktavlar Yasası" adını verdi.
Newlands dizisini yeniden düzenledi ve paralellikleri daha da belirgin hale getirmek için öğeleri yedişer sıralı sütunlar halinde sıraladı. Artık tablonun satırlarında şaşırtıcı derecede çok sayıda karşılaştırılabilir element vardı. Bu şekilde magnezyum kalsiyum, stronsiyum ve baryumun yanında yer alırken, flor klor, brom ve iyodun yanında yer alıyordu.
Arada, lityum ve sodyum arasındaki sıradaki gümüş ya da klor ve iyot arasına yerleştirdiği nikel ve paladyum gibi önemli aykırı elementler de vardı. Ancak bu, element özelliklerinin komşularınınkinden ne kadar farklı olduğu nedeniyle bugün mümkün değildir. Diğer seriler, özellikle de en alttakiler, bir sistem ya da benzerlik belirtisi olmaksızın tamamen farklı elementlerden oluşuyordu.
Peki ama neden? Newlands elementleri nihayet sıralamaya yaklaştığına ve sisteminin tamamen yanlış olamayacağına inanıyordu. Ancak "aykırı değerler" sorununu kontrol edemiyordu.
Ama aynı zamanda binlerce kilometre doğuda bu sorunun çözümü için inatla çalışan başka biri daha vardı: Dimitri Mendeleyev.
Mendeleyev'in Periyodik Yasası
"Her şey kafamda şekillendi ama ifade edemiyorum."
1869 yılının başlarında St. Petersburg Üniversitesi'nde saf kimya profesörü olan Dimitri Mendeleyev, birkaç haftadır ofisine kapanmıştı. Dersleri dışında hiç boş vakti yoktu. Bir şeyler peşindeydi. Çağdaşlarının çoğu gibi o da elementlerin temel düzenini arıyordu ve buna yaklaştığını hissediyordu.
Bir Elementin Bağ Kurma Yeteneği
Mendeleyev, tıpkı John Newlands gibi, atom ağırlıkları ile kimyasal elementlerin özellikleri arasında bir bağlantı olması gerektiğini uzun zamandır anlamıştı. Ancak ikincisinin aksine, değerlik veya değeri de dikkate aldı. Elementlerin 1852'de Edward Frankland tarafından tanımlanan bu özelliği, hidrojen atomları gibi diğer atomlarla bağ kurma yeteneklerinin ne kadar güçlü olduğunu gösteriyordu. Ya da başka bir deyişle, atomlar arasında bağ kurmak için mevcut olan "serbest kolların" sayısı.
Newlands gibi Mendeleyev de elementleri önce atomik kütlelerinin artan sırasına göre dizdi. Daha sonra dikkatini değerliklere çevirdi ve bunların da döngüler halinde ortaya çıktığını fark etti. Lityumdan florine, birden yediye kadar yükseldiler, ancak sodyum daha sonra birden başladı ve değerler bir kez daha klorine kadar yükseldi. Ancak daha sonra, yedi düzeni sona erdi: Bir sonraki periyot zaten önemli ölçüde daha uzundu; bu noktada, element davranışının Newland'ın katı oktav düzeninden ayrıldığı görülüyordu.
Elemental Kart Oyunu
Peki elementler hangi şemaya uyuyordu? Şubat 1869'da bir arkadaşı Mendeleyev'i üniversitedeki ofisinde ziyaret ettiğinde, Mendeleyev'in hala boğuştuğu soru tam da buydu. Arkadaşı ona dehşet içinde ne üzerinde çalıştığını sordu. Mendeleyev, elementlerin periyodik bir sistemi olduğunu bulmasına rağmen, eşleşen bir tablo sistemi veya bir yasa oluşturamadığını açıkladı. Yorgun kimyager, "Her şey kafamda şekillendi ama ifade edemiyorum" diye yakınıyordu.
Ancak Mendeleyev ısrarcıydı. Daha sonra yaptığı bir açıklamada, "Bir şey aradığınızda – ister mantar ister bir tür yasa olsun – aramaya devam etmekten ve tekrar denemekten başka yol yoktur" demiştir. Bu deneyler için birincil aracı, Bunsen brülörü veya başka bir kimyasal cihaz yerine bir yığın düz karton karttı. Bir elementin atom kütlesini ve değerlik gibi en belirgin özelliklerini her birinin üzerine not etti. Daha sonra, sonunda bir sistem oluşana kadar kartları masasının üzerinde karıştırdı.
Yedi Grup
Her şey birdenbire anlaşılır hale gelmişti: Elementler yedi gruba ayrılmıştı ve bu grupların her biri birbiriyle dik olarak ilişkili özelliklere sahip elementleri bir araya getiriyordu. Elementlerin atom kütleleri ve değerlikleri, bu grupların yan yana yerleştirilmesinin bir sonucu olarak, sistemin yapısının sıralarında veya periyotlarında yükseldi. Önce toprak alkali metaller grubu, ardından alkali metaller geldi. Borun başını çektiği "toprak metalleri "ni karbon, nitrojen ve oksijen grupları izledi. Son olarak da flor, klor, brom ve iyottan oluşan halojenler geliyordu.
Mendeleyev artık element düzeninin temelde işleyebilmesinin tek yolunun bu olduğunu anlamıştı. Ancak, ilk bakışta onun da genel tabloyu bozan bazı anormallikleri varmış gibi görünüyordu.
Mendeleyev'in Periyodik Tablosunu Benzersiz Kılan Neydi?
Alman kimyager Lothar Meyer de Mendeleyev ile neredeyse eş zamanlı olarak neredeyse aynı periyodik tablo üzerinde çalışmıştır. Meyer de temel grup ve periyot kavramını anlamış olmasına rağmen, sadece altı grup bulabilmiştir. Meyer de Mendeleyev'e benzer şekilde genel resmi önemli ölçüde bozan birkaç faktörle karşılaştı.
Hatalar ve Boşluklar Nasıl Ele Alınmalıdır?
Örneğin, en hafif üçüncü element olduğu düşünülen berilyum en önde olmalıydı. Ancak, ilk grup berilyumun da bir parçası olabileceği alkali metallerden oluştuğu için plana uymuyordu. Atom ağırlığı 127,6 ve değerliği 2 olan Tellür elementi de yanlış konumlandırılmış gibi görünüyordu. Atom ağırlığına göre iyodun arkasında yer alması gereken bu elementin değerliği açıkça oksijen grubunun değerliğine denk geliyordu ve bu da onu iyot ve diğer halojenlerden önceki element grubuna yerleştiriyordu.
Meyer'in aksine Mendeleyev'in hiçbir tereddüdü yoktu. Teorisine çok güvendiği için, sadece bu anomalilerin atom ağırlıklarının yanlış hesaplandığı sonucuna varabilirdi. Mendeleyev, daha düşük atom ağırlığına rağmen berilyumu hemen dördüncü sıraya taşıdı. Tellür oksijenle birlikte kategorize edildi.
Buna ek olarak Mendeleyev, meslektaşlarının son derece aykırı bulduğu başka bir şey daha yaptı: Periyodik tabloda, kendi görüşüne göre henüz keşfedilmemiş elementlerin dahil edilmesi gereken boşluklar bıraktı. Mendeleyev makalesinde, "Henüz bilinmeyen birçok elementin keşfedilmesini beklemeliyiz, örneğin … atom ağırlığı 65 ila 75 arasında olacak alüminyum ve silikon." demiştir.
Elementlerin Temel Düzenlemesi
Mendeleyev periyodik tablosunu Meyer'den sadece birkaç ay önce, 6 Mart 1869'da "On the Relationship of the Properties of the Elements to their Atomic Weights" (Elementlerin Özelliklerinin Atom Ağırlıkları ile İlişkisi Üzerine) başlığı altında yayınladı ve burada atomik ağırlık değişimlerini ve boşlukları da açıklayarak periyodik tablosunun temelini oluşturan yasaları belirtti:
- Elementler atom ağırlıklarına göre sıralandığında, özellikleri periyodiklik gösterir.
- Benzer kimyasal özellikleri paylaşan elementlerin atom ağırlıkları ya hemen hemen aynıdır (platin, iridyum, osmiyum) ya da atom ağırlıkları düzenli aralıklarla artar (örneğin potasyum, rubidyum, sezyum).
- Elementlerin ve grupların artan atom ağırlığına göre sıralanması, değerliklerine ve bir dereceye kadar özelliklerine karşılık gelir.
- Elementlerin atom ağırlıkları, bazı ayırt edici özelliklerini tahmin etmek için kullanılabilir.
Mendeleyev'e göre, periyodik sisteminin elementlerin temel düzenini yansıttığı ve basitçe keyfi ya da rastgele bir sistem olmaktan ziyade kimyanın doğal yasasını oluşturduğu aşikârdı.
Mendeleyev'in Element Tahminleri Tartışmalara Neden Oldu

Mendeleyev, Periyodik Tablosu yayınlandığında yarışı kazandı. Hem elementleri anlamlı bir şekilde düzenlemede hem de özelliklerinin altında yatan örüntüleri aydınlatmada başarılı olan ilk kişiydi. Ancak çağdaşları bunun için onu tam olarak tebrik etmediler. Tam tersi bir durum söz konusuydu.
"Duyulmamış ve Kanıtlanmamış"
Gelen tepkiler kayıtsız bir soğukkanlılıktan düpedüz reddetmeye kadar değişiyordu. Ne de olsa, ülkenin en ücra köşelerinden gelen bu Rus kimyager, en ünlü çağdaşlarından ve seleflerinden bazılarını yanlış sonuçlar üretmekle suçlayarak neredeyse ifşa etme cüretini göstermişti. Böyle bir davranış kabul edilemezdi. Meyer rakibini " gerekçesiz yorumları " nedeniyle kamuoyu önünde azarladı. Diğerleri ise Meyer'in sisteminin kısa süreceğini, çünkü her halükarda kısa süre içinde modasının geçeceğini öngörüyordu. İnsanlar Mendeleyev'in periyodik tablosunun uygulamalı bilime neler getireceğinden tamamen habersizdi.
"Eka" Elementleri Hakkında
Yine de Mendeleyev bundan geri adım atmayı reddetti. Mendeleyev'e göre, ne kadar temel olursa olsun, hiçbir doğa yasası bir anda oluşmamıştır. Bu yasaların öncesinde her zaman çok sayıda önyargı vardı. Bunun yerine, 1870 yılında Mendeleyev bir adım daha ileri giderek henüz keşfedilmemiş elementler hakkında tahminlerde bulundu ve silisyum, bor ve alüminyumun her birinin altında hala keşfedilmemiş ve bulunması gereken başka bir element olduğunu söyledi.
Mendeleyev bu elementlere Sanskritçe "bir" anlamına gelen "eka" kelimesinden esinlenerek Eka-alüminyum, Eka-bor ve Eka-silikon isimlerini vermiş ve atomik kütleleri, özgül ağırlıkları, oluşturdukları tuz türleri ve hatta erime noktalarının yeri de dahil olmak üzere özelliklerini daha önce tanımlamıştı. Örneğin Eka-alüminyum, atom ağırlığı 68 ve yoğunluğu 6 olan gümüşi beyaz bir metal olacaktı. Ancak Mendeleyev bunun için övgüden çok alay konusu oldu.
Ancak Galyum Var

Bu durum beş yıl sonra, Kasım 1875'e kadar değişmeyecekti: Fransız kimyager Paul-Émile Lecoq de Boisbaudran, bir çinko cevherinin emisyon spektrumunda bilinen element imzalarının hiçbiriyle eşleşmeyen iki mor spektral çizgi buldu. Kısa bir süre sonra Boisbaudran, çinko blende'den tanımlanamayan gümüşi beyaz bir metal çıkarmayı başardı.
Muhtemelen memleketi Fransa'ya bir övgü olarak bu metale galyum adını verdi. O ve diğerleri, keşfini yayınlayana kadar galyumun Mendeleyev tarafından öngörülen eka-alüminyuma tam olarak karşılık geldiğini fark etmediler.
Daha sonra, 1879'da Mendeleyev'in öngördüğü ikinci element olan eka-bor İsveçli kimyager Lars Fredrik Nilson tarafından bulundu. Alman kimyager Clemens Winkler, 1885 yılında Saksonya'nın Freiberg kenti yakınlarındaki bir madende üçüncü element olan germanyumu keşfetti. Mendeleyev en sonunda bu noktada sadece haklı çıkmakla kalmamış, aynı zamanda kimyanın en büyüklerinden biri olarak resmen kabul edilmişti.
Ancak birkaç yıl sonra, tüm periyodik sistemini bir kez daha sarsabilecek bir şey oldu.
Mendeleyev'in Sisteminden Soy Gazların Keşfi
Periyodik Tabloyu Alt Üst Edecek Elementler
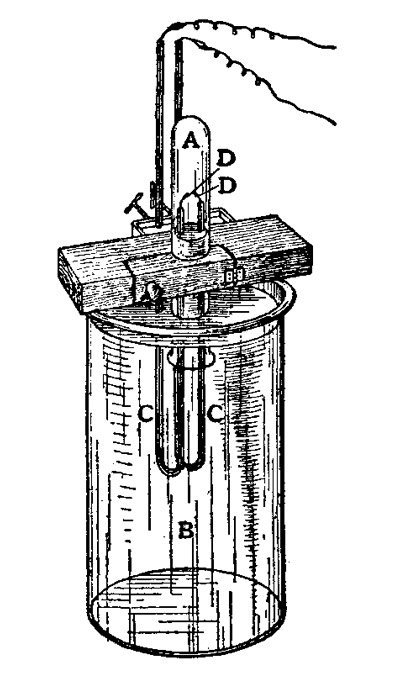
1892'de İngiltere'de Cambridge Üniversitesi'ndeki bir laboratuvarda, bir fizikçi olan Lord Rayleigh, John William Strutt, dikkatle çalışma tezgahının üzerine eğilmişti. Önünde, oksijen amonyak sıvısı içinde fokurduyor, ardından son derece sıcak olan bakır bir tüpün içinde kayboluyordu. Diğer uçta çok daha küçük kabarcıkların ortaya çıktığı görülüyordu. Rayleigh'in bu durumda ilgilendiği gaz nitrojendi. Oksijen ve amonyağın hidrojeni tepkimeye girdiğinde açığa çıkan şey buydu.
Rayleigh, nitrojenin atom ağırlığını nihayet belirleyebilmek için bir süredir bu gazın yoğunluğunu eskisinden daha hassas bir şekilde ölçmeye çalışıyordu. Rayleigh, metodolojik bir hata olmadığından emin olmak için testi birkaç kez tekrarladı. Ayrıca, azotun sıcak bakır üzerinden geçirilerek doğrudan havadan alındığı farklı bir ölçüm tekniği kullandı.
Esrarengiz Bir Sapma

Fizikçi 1904 Nobel Ödülü konuşmasında " kendi kendisiyle uyum içinde olan bir dizinin nasıl ortaya çıktığını" anlatmıştır. Ona göre, iki yöntemle elde edilen yoğunluklar arasında binde bir oranında fark vardı ve bu fark küçük olsa da olası deneysel hataların tamamen ötesindeydi. Amonyaktan elde edilen azot gazının yoğunluğu havadakinden daha küçüktü. Ve bu farkın bilinen safsızlıklardan kaynaklanıp kaynaklanamayacağı sorusu ortaya çıktı.
Rayleigh bu sorunu çözmek için University College London'da araştırma yapan İskoç kimyager William Ramsay'e danıştı. Her ikisi de atmosferdeki azotun tanımlanamayan bir element içerebileceğine inanıyordu. Azottan daha yoğun olan ve herhangi bir şey tarafından reaksiyona sokulamayan renksiz gazdan oluşan küçük bir kabarcık her zaman varlığını sürdürdü ve bu durum en az iki deneysel yaklaşımla doğrulandı. Ama amaç neydi? Ramsay, nispeten yeni bir teknik olan spektroskopideki spektral çizgileri ya da kimyasal parmak izini temel alan bir resim oluşturdu.
Boşluğu Olmayan Elementler
Gaz analizinden çıkan çizgiler bilinen tüm element izlerinden farklıydı. Bu tamamen yeni, keşfedilmemiş bir element olmalıydı. Ramsay ve Rayleigh, Yunanca atıl anlamına gelen "argos" kelimesinin etkisiyle gaza "argon" adını verdiler ve keşiflerini 31 Ocak 1895'te resmileştirdiler. Daha yakından bakıldığında argonun atom ağırlığının 40'ın hemen altında olduğu görüldü. Dolayısıyla teorik olarak periyodik tabloda kalsiyum (atom ağırlığı 40) ve potasyum (atom ağırlığı 39) arasında yer alması gerekirdi.
Ancak Mendeleyev, alkali ve toprak alkali metaller arasında bir boşluk keşfetmemişti. Belki de periyodik tablosu her şeye rağmen yanlıştı? Elementler yasasını kavradığı iddia ediliyorsa, tabloya uymayan bir element nasıl olabilirdi?
Yeni Bir Grubun Oluşumu

Büyük bir keşif, yeni oluşturulan periyodik düzenin yıkılmasından başka bir şeyi tehdit etmiyordu. Ancak Ramsay bir çözüm buldu. Gaz hiçbir şeyle ya da kimseyle etkileşime girmek istemediğinden, argonun değerliğinin 0 olması gerektiği sonucuna vardı. Sonuç olarak, farklı değerliklere sahip potasyum ve kalsiyum arasına uymuyordu. Bunun yerine periyodik tabloda henüz keşfedilmemiş farklı bir grubun üyesi olacaktı. Ramsay daha sonra argonu klorun arkasına yerleştirerek sekizinci gaz grubu olan soy gazları oluşturdu. Ancak bu grupta başka elementler de olmalıdır çünkü periyodik tablodaki hiçbir element tek başına var olamaz.
Aslında Mendeleyev'in "Elementler Yasası "nın bir kez daha ürkütücü bir şekilde öngörülü olduğu ortaya çıktı: Ramsay 1895 yılında ABD'deki bir uranyum mineralinden daha önce tanımlanamayan bir gazın izole edildiğini keşfetti ve kısa bir süre sonra spektroskopta inceledi. Çizgiler, daha önce Güneş'te görülmüş ancak henüz sınıflandırılmamış bir element olan helyumdan oluşuyordu. Ramsay artık helyumun da bir soy gaz olduğunu tespit etmişti çünkü dört atom ağırlığıyla grubun en üst sırasını tutuyordu. Ramsay birkaç yıl sonra üç soygaz daha buldu ve bunlara neon, kripton ve ksenon isimlerini vererek sekizinci grubu doldurdu.
Günümüzde Periyodik Tablo
Soy gazların keşfiyle birlikte Mendeleyev'in tanımladığı element düzeni ilk ateşle imtihanında zafer kazandı. Periyodik tablo, daha sonra itriyum ve diğer nadir toprak elementlerinin keşfiyle bile artık sarsılmaz hale gelmişti. Rus kimyacının keşfettiği yasalar bugün hala yürürlüktedir
Yeni Bilgiler Eski Düzeni Güçlendiriyor
Daha sonraki keşifler fizik ve biyolojideki dünya görüşlerini altüst etmiş olsa da Mendeleyev'in "elementlerin temel düzeni" olarak adlandırdığı periyodik tablonun aslında evrensel olduğu ortaya çıkmıştır. Bunun yerine, atom kabuğunun yapısından elementlerin bağlanma şekline kadar kimyadaki bir dizi önemli gelişme, o zamandan beri Periyodik Tablo sistemini desteklemiştir.
Örneğin, Niels Bohr 1913'te atom kabuğundaki elektron dağılımının, değerlik kavramından yola çıkarak elementlerin bağlanma davranışının temelini oluşturduğunu göstermiştir. Bohr'un keşfi aynı zamanda Mendeleyev'in periyodik tablodaki her bir element grubunun dış kabuklarında belirli sayıda elektron bulunduğuna dair teorisine fizikokimyasal bir kanıt sağladı. Temel özelliklerden büyük ölçüde sorumluydular ve bu da Mendeleyev'in henüz keşfedilmemiş elementlerin belirli özelliklerini doğru bir şekilde tahmin etmesini sağladı.
Elementleri Aramak İçin Yol Gösterici Yıldız
Mendeleyev tarafından geliştirilen "öngörü" ilkesi bugün de ardılları tarafından kullanılmaktadır. Dolayısıyla Mendeleev'in periyodik yasası yol gösterici bir yıldızdır. 1940'larda ilk yapay element yaratıldığında, en büyük soru onu nasıl tanımlayacağımız ve özelliklerini nasıl açıklayacağımızdı. Çünkü Uluslararası Saf ve Uygulamalı Kimya Birliği (IUPAC), yeni keşfedilen ya da yaratılan bir elementin, özellikleri tanımlanana kadar resmi olarak tanınmamasına ve adlandırılmamasına karar verdi. Örneğin son derece kararsız ve çabuk bozunan transuranyum elementleri için bu pek mümkün değildir.
Şu anda 118 element tanımladık, bu da periyodik tabloda 118 element olduğu anlamına geliyor. Bir elementin özelliklerini periyodikliğinden çıkarmanın oldukça kolay olduğu kanıtlanmıştır. Mendeleyev ve çağdaşları bu elementlerin egzotik özelliklerinden bazılarını hayal bile edemezlerdi. Ve en zorlu koşullar altında devasa parçacık fırlatıcılarında üretilen bu elementlerden hala daha fazlası var. Kimse üst sınırın nerede olduğundan ya da periyodik tabloda daha kaç element olabileceğinden tam olarak emin değil.
Kaynaklar:
- Döbereiner, J. W. (1829). "An Attempt to Group Elementary Substances according to Their Analogies"– Lemoyne College, New York, USA.
- History of the Periodic Table, Malevus.
- Mendeleev, Dmitri (1869). "On the relations of properties of the elements to their atomic weights."
- Boyle, Robert (1661). The Skeptical Chymist. London, England: J. Crooke. p. 16.
- Periodic Table of Elements – IUPAC | International Union of Pure and Applied Chemistry
- 1st periodic table is presented, March 6, 1869 – EDN




