DNA metilasyonu, DNA molekülünün sitozin bazına bir metil grubunun bağlandığı bir süreçtir ve DNA'nın epigenetik olarak işaretlenmesinin önemli bir yoludur.
Epigenetik modifikasyonlar, gen ifadesini düzenlemek için açma-kapama anahtarları olarak hareket edebilir ve altta yatan DNA dizisini değiştirmeden çeşitli hücre tiplerinin oluşturulmasına yardımcı olabilir. Örneğin vücut, beyinle ilgili genlerin kalp hücrelerinde açılmamasını bu şekilde sağlar.
Bu nedenle, DNA metilasyon modelinin korunması, her hücre tipinin doğru ve tutarlı işlevini sağlamak için önemlidir.
Ancak bu kolay bir başarı değildir: DNA metilasyon modeli zamanla değişebilir ve bu çeşitli hastalıklarla bağlantılıdır.
Bunlardan biri, immün yetmezlik, sentromerik instabilite ve yüz anomalileri (ICF) sendromu olarak adlandırılan ve semptomları arasında tekrarlayan solunum yolu enfeksiyonları, yüz anomalileri ve yavaş büyüme ve biliş bulunan nadir bir genetik durumdur.
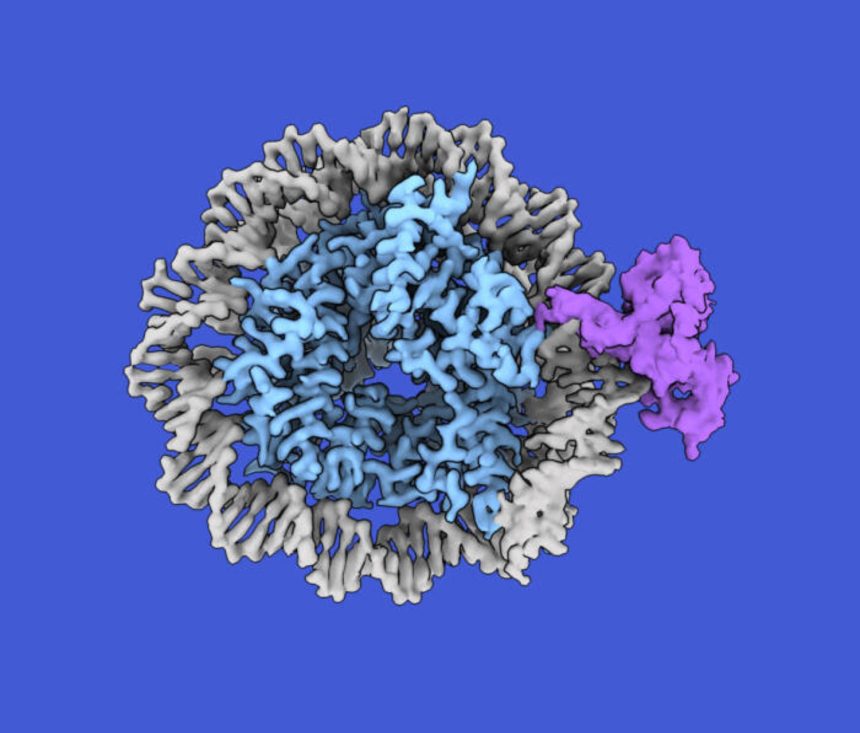
CDCA7 genindeki mutasyonların ICF sendromuna neden olduğu bilinmekle birlikte, genin moleküler işlevi hakkında çok az şey biliniyordu.
Yeni araştırmada, Rockefeller Üniversitesi Profesörü Hironori Funabiki ve meslektaşları, CDCA7'nin DNA metilasyonunun doğru kalıtımını sağlayan benzersiz bir işlevsel özelliğini tanımladı.
Araştırmacılar CDCA7'nin ökaryotlarda hemimetilasyonu algıladığını keşfetti – bu önemli bir bulgu, çünkü hemimetilasyon algılamanın uzun zamandır yalnızca UHRF1 adlı bir protein tarafından gerçekleştirildiği düşünülüyordu.
Rockefeller Üniversitesi'nden bilim insanı Isabel Wassing, "Bu oldukça inanılmaz bir bulgu" dedi.
"CDCA7'nin aynı zamanda bir sensör görevi gördüğünü öğrenmek, mutasyonunun neden ICF sendromu gibi hastalıklara yol açtığını açıklıyor ve epigenetik alanındaki büyük bir boşluğu dolduruyor."
"Ama aynı zamanda yeni soruları da beraberinde getirdi. Örneğin, hücre neden iki farklı hemimetilasyon sensörüne ihtiyaç duyar?"
Tokyo Üniversitesi araştırmacısı Atsuya Nishiyama, "ICF sendromunun nedensel geni olarak bilinen CDCA7 geninin, nükleozomlar üzerindeki hemimetillenmiş DNA'ya spesifik bağlanma yoluyla histon H3'ün ubikitinasyonunu kontrol ederek DNA metilasyonunu teşvik ettiğini bulduk" dedi.
Bilim insanları, DNA'ya metilasyon uygulamak için gerekli olanlar da dahil olmak üzere birçok enzim ve DNA bağlayıcı proteinin erişiminin kromatin tarafından kısıtlandığını biliyor.
Profesör Funabiki'nin ekibi tarafından daha önce yapılan araştırmalar, CDCA7'nin, mutasyonları ICF sendromuna da neden olan HELLS geni tarafından kodlanan proteinle bir kompleks oluşturduğunu gösterdi.
HELLS, DNA molekülünü nükleozomdan geçici olarak çözebilen, nükleozom yeniden şekillendiricisi olarak adlandırılan bir proteindir.
Profesör Funabiki, "CDCA7-HELLS kompleksinin, hücrenin sıkıştırılmış heterokromatin bariyerini aşmasına ve DNA molekülünü metilasyon birikimi için erişilebilir hale getirmesine yardımcı olmak için önemli olduğunu öngördük" dedi.
"Ancak DNA molekülünü bu şekilde açığa çıkarabilen birçok farklı nükleozom yeniden şekillendirici var."
"CDCA7-HELLS'in neden DNA metilasyonunun sürdürülmesiyle doğrudan ilişkili tek nükleozom yeniden şekillendirme kompleksi olduğu bizim için bir gizem olarak kaldı."
"CDCA7'nin HELLS'i hemimetillenmiş DNA'ya özel olarak bağladığını gösterdiğimize göre, bu nihayet bir açıklama sağlıyor."
Bu modelde, CDCA7 kromatindeki hemimetillenmiş DNA'yı tanır ve bir nükleozom yeniden şekillendirici olarak nükleozomu yoldan kaydırarak hemimetilasyon bölgesini UHRF1'e ortaya çıkaran HELLS'i bölgeye alır.
Hemimetilasyon algılamasının el değiştirmesi, CDCA7'nin yoğun heterokromatin içindeki hemimetilasyonu tespit etmede UHRF1'den daha iyi olduğunu gösterir. Ayrıca hücrenin iki farklı sensöre olan ihtiyacını da açıklıyor.
Dr. Wassing, "Bu sensörlerin hemimetilasyonu tespit edebilmeleri için hemimetillenmiş DNA substratını doğrudan ve seçici olarak bağlamaları gerekir" dedi.
"CDCA7, DNA nükleozomun etrafına sarılmışken bunu benzersiz bir şekilde yapabiliyor gibi görünüyor. Bu olmadan, UHRF1 nükleozom parçacıkları içindeki hemimetilasyon sinyaline karşı kör olacaktır."
Dr. Nishiyama, "Bulgularımız CDCA7 ve HELLS'in DNA metilasyonunu de novo DNA metilasyonundan farklı bir mekanizmayla desteklediğini göstermektedir ki bu da CDCA7 HMZF alanının, idame DNA metiltransferaz DNMT1'in substratı olan hemimetillenmiş CpG'yi spesifik olarak tanıdığını göstermemizle pekişmiştir" dedi.
"CDCA7 genindeki ICF hastalığıyla ilişkili mutasyonlar, hemimetillenmiş DNA bağlanmasını ortadan kaldırarak CDCA7 tarafından hemimetilasyon tespitinin işlevsel önemini desteklemektedir."
Bu yeni anlayış, işlevsiz metilasyondan doğan hastalıkların altında yatan mekanizmaların aydınlatılmasına yardımcı olabilir.
Gelecekte, hemimetilasyon sensörleri için DNA metilasyonunun sürdürülmesinin ötesinde işlevler arayacaklar.
"Bazı kromozomal bölgelerin hemimetilasyon durumunu koruduğu bilindiğinden, CDCA7 tarafından tanınmaları gen düzenlemesi ve kromozom organizasyonunda çok daha geniş rollere sahip olabilir. Bu heyecan verici bir olasılık," diyor Profesör Funabiki.
Dr. Nishiyama, "Çalışmamız, ICF sendromu için yeni DNA metilasyon inhibitörlerinin ve terapötik ilaçların geliştirilmesine zemin hazırlıyor" dedi.
"CDCA7'ye bağlı DNA metilasyonunu yapay olarak düzenleyen tedaviler de kanseri ve yaşlanmayı önleyebilir ve sağlıklı yaşam süresini uzatmaya yardımcı olabilir."
Bulgular bu ay Science Advances dergisinde yayınlandı.